Auricher Wissenschaftstage –
Forum einer dritten Kultur
Praktikum im Bereich Organische Chemie der LMU München
vom 7. bis zum 18. Dezember 2009
Von Claudia Diehl
Vom 07.12.2009 bis zum 18.12.2009 habe ich im Rahmen der Auricher Wissenschaftstage ein Praktikum an der Ludwig-Maximilians-Universität in München im Arbeitskreis von Prof. Dr. Carell im Fachbereich der organischen Chemie absolvieren können.
Der Arbeitskreis von Prof. Dr. Carell befasst sich hauptsächlich mit
der Untersuchung von natürlich auftretenden Schädigungen der DNA, wie
beispielsweise eine Veränderung der ursprünglichen DNA durch
Umwelteinflüsse wie UV-Strahlung, freie Radikale oder Oxidation. Von
bestimmten „Schäden“, also Deformationen der DNA ausgehend, untersuchen
die Mitarbeiter des Arbeitskreises im Bereich der Grundlagenforschung
die Folgen eines DNA-Schadens für die DNA-Replikation sowie für die
Proteinsynthese. Des Weiteren wird die Wirkungsweise von speziellen
DNA-reparierenden Enzymen erforscht.
Während meines Praktikums lernte ich in einem Rundgang durch die Labore
des Arbeitskreises die einzelnen Schritte von der zu erforschenden
Fragestellung bis zur abschließenden Klärung der Wirkungsweise eines
DNA-Schadens kennen.
Der grundsätzliche Arbeitsablauf der Bearbeitung eines Projektes
umfasst sieben verschiedene Arbeitsphasen:
Zunächst wird eine noch nicht untersuchte Fragestellung, beispielsweise
die Untersuchung eines speziellen DNA-Schadens (alternativ auch eines
bestimmten Enzyms oder der DNA oder RNA einer bestimmten Zellart),
ausgewählt.
In der folgenden Arbeitsphase wird nun eine Synthesemethode dieses
speziellen DNA-Schadens entwickelt sowie anhand dieser Methode eine
bestimmte Menge einer schadhaften Nukleinbase synthetisiert. Diese
Synthese erfordert in der Regel eine Abfolge von 15- 20 Teilschritten,
bis das gewünschte Produkt entsteht. Da jedem einzelnen Teilschritt der
Synthese auch noch eine sorgfältige Aufreinigung folgt, benötigt man
allein für die Synthese eines DNA-Schadens bei bekanntem Mechanismus oft
einige Wochen.
Nach Abschluss der Synthese werden mit Hilfe eines DNA-Synthesizers
DNA-Stränge einer bestimmten Basenfolge, die auch die schadhafte Base
enthält, hergestellt.
Die zwangsläufig entstandene Produktmischung, da nicht immer alle Stränge
vollständig entstehen, wird im Anschluss per HPLC
(Hochdruck-Flüssigkeitschromatographie), einer sehr effektiven Methode
zur Aufreinigung und Analyse von Stoffgemischen, aufgetrennt und die
gewünschten DNA-Stränge isoliert aufgefangen. Diese werden im Anschluss
aus der Flüssigphase in eine feste Phase überführt, beispielsweise durch
Sublimation unter Vakuum.
Nun werden einige analytischen Messungen an den DNA-Strängen vorgenommen:
Zunächst wird überprüft, ob die Masse des tatsächlichen Produkts mit der
des Wunschprodukts übereinstimmt, also ob es sich tatsächlich um das
Wunschprodukt handelt. Des Weiteren wird überprüft, ob die DNA-Stränge
sich über Wasserstoffbrückenbindungen zu Doppelsträngen zusammengefügt
haben, indem die Absorption des Produkts bestimmt wird. Schließlich wird
noch festgestellt, ob die DNA-Struktur mit der in der Natur häufigsten
Struktur b übereinstimmt und nicht etwa die Struktur a oder die
Struktur z aufweist.
Sind diese Analytiken abgeschlossen, kann die eigentliche Untersuchung
der Wirkweise des DNA-Schadens beginnen. Dafür wird beispielsweise der
DNA eines Bakteriums eine bestimmte Sequenz entnommen, statt derer dann
die zuvor synthetisierte DNA eingesetzt wird. Eine Beobachtung der
Bakterienkolonie sowie der Transkription eines einzelnen Bakteriums kann
dann Aufschluss darüber geben, wie bestimmte replizierende oder
transkribierende Enzyme auf den Schaden reagieren – ob sie an ihm stoppen
und die Arbeit dort abbrechen, ob sie die schadhafte Base überlesen, was
zu einer Delektion, d. h. einer
Basenverschiebung innerhalb der DNA-Sequenz, führt oder ob sie gegenüber
des Schadens die richtige oder aber eine falsche Base einsetzen.
Letztlich soll festgestellt werden, ob und in welcher Hinsicht durch den
DNA-Schaden das in der Genexpression gebildete Protein Schaden in seiner
Struktur nimmt. Ist dies erforscht, können schließlich die Ergebnisse
veröffentlicht werden. Eventuell finden diese Erkenntnisse in
zukünftigen Medikamenten, beispielsweise gegen Krebs, Anwendung.
Während meines Praktikums konnte ich im Bereich der organischen Chemie
an der Synthese verschiedener DNA-Schäden mitarbeiten. Wichtige
Teilschritte der arbeitsaufwändigen Synthese sind die Anbringung von
Schutzgruppen an reaktiven Teilgruppen oder Atomen des Eduktes, die
ansonsten unbeabsichtigt reagieren würden, ihre Struktur jedoch behalten
sollen.
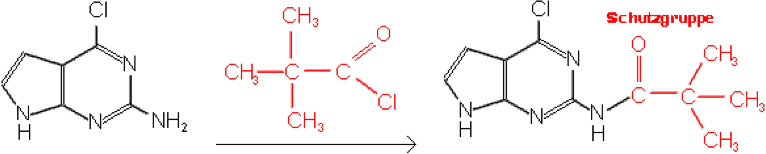
Um im folgenden Beispiel, an dem ich während meines Praktikum
mitarbeitete, die NH2-Gruppe zu schützen, wird in einem
Teilschritt diese Aminogruppe mit Pivaloylchlorid zur Reaktion gebracht,
bei der sich die beiden Edukte unter Abspaltung eines Protons und eines
Chloridions addieren, sodass die Aminogruppe in den folgenden Reaktionen
durch die Schutzgruppe von einer Reaktion abgehalten wird:
Aufgrund der Empfindlichkeit der Substrate ist es dabei notwendig,
dass alle Reaktionen unter Schutzgasatmosphäre, zum Beispiel in Argon,
ablaufen, da bei Kontakt mit Wasser oder Sauerstoff die Substrate
Konkurrenzreaktionen eingehen würden.
Nach dem Ende der Reaktion, die bei Raumtemperatur innerhalb von zwei
Stunden abläuft, muss das Reaktionsgemisch aufgereinigt werden, da man
nicht davon ausgehen kann, dass nur diese eine Reaktion abläuft. Der
erste Reinigungsschritt ist das Ausschütteln, bei dem polare unerwünschte
Substanzen abgetrennt werden. Im Anschluss wird das in Lösungsmittel
gelöste Substrat ausgetrocknet, indem MgSO4 dem Lösungsmittel
beim Ausschütteln eventuell entstandenes Wasser entzieht.
Schließlich wird das Produktgemisch noch gefiltert und
säulenchromatographisch aufgereinigt. Dabei wird auf eine feste Phase,
in diesem Fall das polare Kieselgel, das Produktgemisch aufgetragen und
mit einem unpolaren Fließmittel als mobile Phase durchgespült. Aufgrund
verschiedener Polaritäten trennen sich die einzelnen Produkte der
Mischung auf und können in Fraktionen aufgefangen werden. Mit einer
Dünnschichtchromatographie wird dann nachgewiesen, welche Fraktion das
gereinigte Wunschprodukt enthält, das dann das Ausgangsprodukt für die
nächste Teilrektion ist.

Gelelektrophoreseapparatur
(Quelle: Wikipedia)
Im Bereich der Biochemie konnte ich unter anderem die Methode der
Gelelektrophorese kennen lernen, mit der festgestellt werden kann, ob
ein schadhafter DNA-Strang auch noch an und nach dem Schaden verlängert
wird. Dazu werden zunächst schadhafte DNA-Stränge mit bestimmten
Polymerasen sowie mit je einer Basenart (G/C/A/T) zusammengegeben, um
dann festzustellen, ob die Polymerase die richtige oder eine falsche
Base zuordnet.
Für diese analytische Methode wird zunächst ein Polyacrylamid-Gel
hergestellt, das ein sehr engmaschiges Netz ausbildet. Ist das Gel
ausgehärtet, werden die Geltaschen mit einer Pufferlösung ausgespült
sowie die Gelelktrophoreseapparatur mit Pufferlösung befüllt. Dann werden
die Substanzen vorsichtig in die Geltaschen eingespritzt und die
Elektrophorese durchgeführt.
Während der Elektrophorese bildet sich ein elektrisches Feld aus, das
bewirkt, dass die Anionen zur positiv geladenen Anode und Kationen zur
negativ geladenen Kathode wandern. Abhängig von der Polarität sowie der
Teilchengröße der Substrate wandern diese verschieden schnell, sodass
man im konkreten Fall am Ende der Elektrophorese eine Auftrennung der
verschiedenen DNA-Fragmente in Abhängigkeit von ihrer Basenlänge erhält.
Betrachtet man diese Fraktionen, kann man ihnen nun entnehmen, welche
Basen die Polymerase dem Schaden zugeordnet hat und somit, wie sich der
Schaden in der Proteinbiosynthese auswirkt.
Zusammengefasst war das Praktikum an der Ludwig-Maximilians-Universität
in München im Arbeitskreis der organischen Chemie für mich sehr lohnend.
So konnte ich die wissenschaftliche Arbeit in der organischen Chemie
realitätsnah erleben und erhielt einen umfassenden Überblick über die
Tätigkeit des Arbeitskreises. Inhaltlich hat mir dieses Praktikum
Einblick in eine Thematik gegeben, die im Schulunterricht im Prinzip
nicht behandelt wird, jedoch sehr interessant ist, da sich die organische
Chemie unter anderem auf molekularerer Ebene mit Körperfunktionen wie
der Wirkungsweise von Enzymen befasst.
Schließlich konnte ich während meines Praktikums in München auch einige
chemische Grundvorlesungen besuchen und erhielt ausführliche
Informationen zum Chemiestudium, sodass ich auch einen Einblick in den
Ablauf eines Chemiestudiums bekam.
An dieser Stelle möchte ich mich bei all meinen Betreuern bedanken,
die mir während der zwei Wochen in einer Mischung aus Theorie- und
Praxiseinheiten ihre Arbeit präsentiert haben und sich dabei sehr viel
Zeit für spontane Führungen, detaillierte Erklärungen und die
Beantwortung meiner Fragen nahmen. Insbesondere möchte ich Frau Voß
danken, die den konkreten Ablauf des Praktikums plante und meine
Hauptansprechpartnerin im Arbeitskreis war.
Schließlich gilt mein Dank der Sparkasse Aurich-Norden, die mit der
Förderung der Auricher Wissenschaftstage mir
dieses Praktikum erst ermöglicht hat, sowie Herrn Stracke, der als
Organisator für Praktika im Rahmen der
Wissenschaftstage den Kontakt zur LMU
hergestellt hat.